mekanisme reaksi SN1
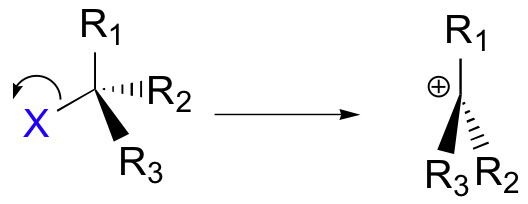
Hal ini menghasilkan pembentukan karbokation: karena karbon pusat hanya memiliki tiga ikatan, ia dikenakan muatan formal +1. Ingatlah bahwa karbokation harus digambarkan sebagai sp 2hibridisasi, dengan geometri planar trigonal.Tegak tegak lurus terhadap bidang yang dibentuk oleh orbital hibrid tiga sp 2 adalah orbital p yang kosong dan tidak dikaburkan.

Pada langkah kedua dari reaksi dua langkah ini, nukleofil menyerang orbital kosong, 'elektron lapar' dari karbokation untuk membentuk ikatan baru dan mengembalikan karbon ke geometri tetrahedral.
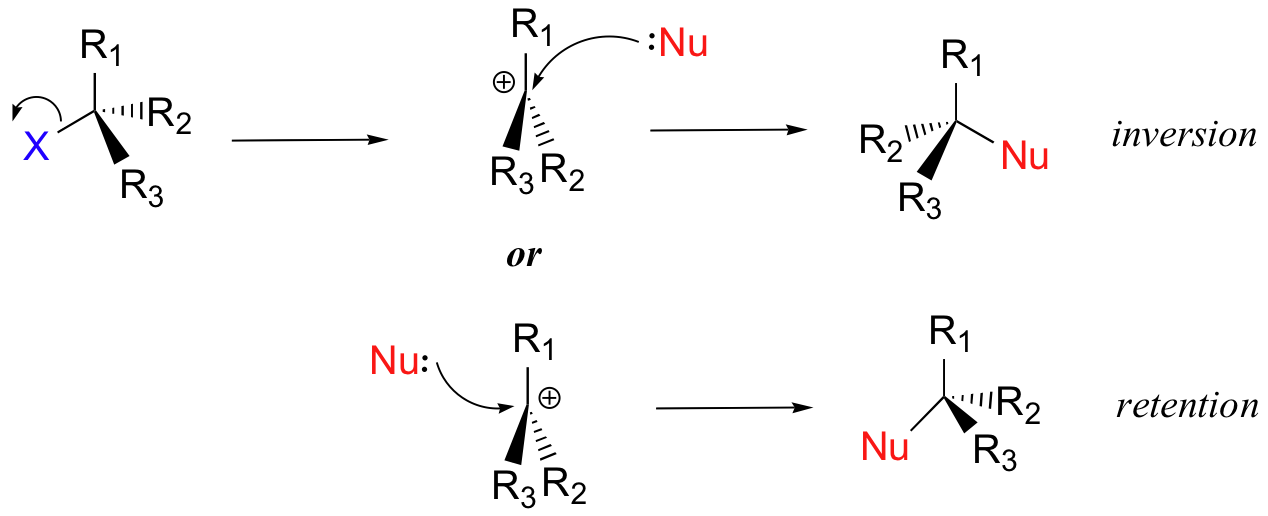
Kami melihat bahwa reaksi S N 2 secara khusus menghasilkan inversi stereokimia di pusat karbon elektrofilik. Bagaimana dengan hasil stereokimia dari reaksi S N 1? Dalam model reaksi S N 1 yang ditunjukkan di atas, kelompok yang meninggalkan terdisosiasi sepenuhnya dari sekitar reaksi sebelum nukleofil memulai serangannya. Karena gugus yang meninggalkan tidak lagi dalam gambar, nukleofil bebas untuk menyerang dari kedua sisi planar, sp2-elektrofil karboksi terkarbonisasi. Ini berarti bahwa sekitar separuh dari waktu produk memiliki konfigurasi stereokimia yang sama dengan bahan awal (retensi konfigurasi), dan sekitar setengah dari waktu stereokimia telah dibalik.Dengan kata lain, rasemisasi telah terjadi di pusat karbon. Sebagai contoh, alkil bromida tersier di bawah ini diharapkan akan membentuk campuran rasemat dari alkohol Rdan S setelah reaksi S N 1 dengan air sebagai nukleofil yang masuk.

Mekanisme Reaksi SN1
Dengan mengambil hidrolisis butil bromida tersier sebagai contoh, mekanisme reaksi SN1 dapat dipahami melalui langkah-langkah berikut.
Langkah 1
-Ikatan karbon-bromin adalah ikatan kovalen polar. Pembelahan ikatan ini memungkinkan pengangkatan gugus yang pergi (ion bromida).
-Ketika ion bromida meninggalkan butil bromida tersier, zat antara karbokation terbentuk.
-Seperti disebutkan sebelumnya, ini adalah langkah penentuan laju mekanisme SN1.
-Penting untuk dicatat bahwa putusnya ikatan karbon-brom adalah endotermik.

Langkah 2
-Pada langkah kedua mekanisme reaksi SN1, karbokation diserang oleh nukleofil.
-Karena air digunakan sebagai pelarut, zat antara ion oksonium terbentuk.
-Karena pelarut bersifat netral, langkah ketiga di mana deprotonasi terjadi diperlukan.

Langkah 3
-Muatan positif pada karboksi dialihkan ke oksigen pada langkah sebelumnya.
-Pelarut air sekarang bertindak sebagai basa dan mendeprotonasi ion oksonium untuk menghasilkan alkohol yang dibutuhkan bersama dengan ion hidronium sebagai produk.
-Langkah 2 dan Langkah 3 dari reaksi ini cepat.

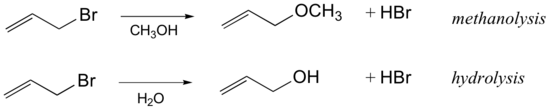
Pengaruh pelarut dalam reaksi SN1


Komentar
Pengaruh pelarut pada mekanisme ini adalah agar mekanisme reaksi SN1 berlangsung baik terutama pada pelarut polar yaitu untuk menstabilisasikan zat antara secara umum dan protik untuk melarutkan gugus lepas secara khususnya. Contohnya air dan alkohol.
Saya Ermawati akan mencoba menjawab permasalahan nomor 1 yang saudari ajukan
Hal yang menyebabkan pembelahan ikatan dapat memungkinkan pengangkatan gugus pergi adalah pembelahan ikatan C-Lv
membentuk intermediate karbokation, ditunjukkan sebagai struktur pada sumur kedua pada karbokation adalah dua elektron yang memusnahkan oktet dan bereaksi cepat dengan nukleofil, seperti metanol pelarut. setelah reaksi karbokation dengan metanol, struktur yang dibuat memiliki proton pada oksigen. Suatu keadaan transisi ada pada diagram energi untuk setiap langkah individu.