Pembentukan dan Sifat-Sifat Asam Karboksilat
Dalam kasus paling sederhana, reaksi sintesis terjadi ketika dua atom atau molekul berbeda berinteraksi membentuk molekul atau senyawa yang berbeda. Sebagian besar waktu, ketika reaksi sintesis terjadi, energi dilepaskan dan reaksi eksotermis. Namun, hasil endotermik juga dimungkinkan. Reaksi sintesis adalah salah satu kelas utama dari reaksi kimia, yang meliputi tetapi tidak terbatas pada, perpindahan tunggal, perpindahan ganda, dan reaksi pembakaran.
Reaksi Sintesis Kompleks
Banyak reaksi sintesis jauh lebih kompleks daripada A + B → C. Misalnya, reaksi sintesis organik dapat melibatkan lebih dari dua molekul yang berbeda, dan campuran produk dapat terjadi bersamaan dengan bahan awal yang tidak bereaksi. Molekul menengah dapat terbentuk yang dapat menyebabkan pembentukan produk samping. Selain itu, tergantung pada bagaimana orientasi dua molekul reaktan bertabrakan, baik produk yang diinginkan dan produk sampingan dapat terbentuk - yang dapat mempengaruhi kemurnian produk. Ada berbagai jenis reaksi sintesis. Jenis reaksi umum ini mungkin yang paling umum dalam kimia. Sebagai contoh, reaksi penambahan dan substitusi nukleofilik dan elektrofilik adalah tipe reaksi luas yang menghasilkan contoh tak terhitung dari reaksi sintesis. Ketika dua atau lebih reaktan bergabung untuk membentuk molekul yang lebih kompleks, komposisi campuran reaksi akhir tergantung pada kondisi di mana reaksi dilakukan.
Reaksi Sintesis Asam Karboksilat
Atom karbon dari gugus karboksil memiliki tingkat oksidasi yang tinggi. Karena itu, tidak mengherankan bahwa banyak dari reaksi kimia yang digunakan untuk pembuatannya adalah oksidasi. Reaksi semacam itu telah dibahas pada bagian sebelumnya dari teks ini, dan diagram berikut merangkum sebagian besar dari ini.
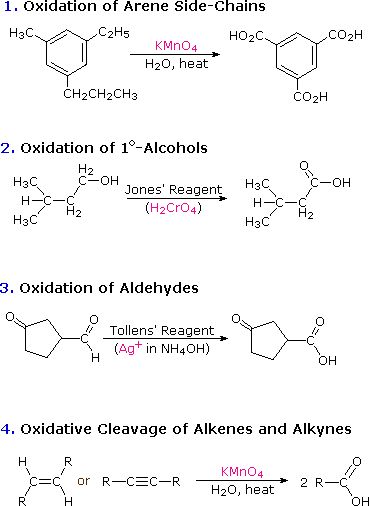
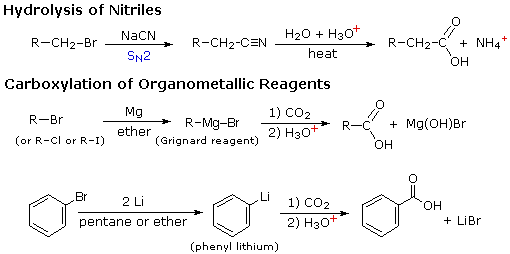
Dua prosedur lain yang berguna untuk menyiapkan asam karboksilat melibatkan hidrolisis nitril dan karboksilasi zat antara organologam. Seperti ditunjukkan dalam diagram berikut, kedua metode dimulai dengan senyawa halogen organik dan gugus karboksil akhirnya menggantikan halogen. Kedua metode ini memerlukan dua langkah, tetapi saling melengkapi karena zat antara nitril dalam prosedur pertama dihasilkan oleh reaksi S N 2, di mana anion sianida merupakan prekursor nukleofilik dari gugus karboksil. Hidrolisis dapat berupa asam atau dikatalisis basa, tetapi yang terakhir memberikan garam karboksilat sebagai produk awal.
Pada prosedur kedua halida elektrofilik pertama kali diubah menjadi turunan logam nukleofilik yang kuat, dan ini menambah karbon dioksida (suatu elektrofil). Produk awal adalah garam dari asam karboksilat, yang kemudian harus dilepaskan dengan pengobatan dengan asam berair yang kuat.
Pada prosedur kedua halida elektrofilik pertama kali diubah menjadi turunan logam nukleofilik yang kuat, dan ini menambah karbon dioksida (suatu elektrofil). Produk awal adalah garam dari asam karboksilat, yang kemudian harus dilepaskan dengan pengobatan dengan asam berair yang kuat.
Asam karboksilat yang ada dapat memanjang oleh satu kelompok metilen, menggunakan prosedur homologasi yang disebut reaksi Arndt-Eistert.
Sifat-Sifat Asam Karboksilat
Tabel di awal halaman ini memberikan titik leleh dan titik didih untuk kelompok asam karboksilat homolog yang memiliki satu hingga sepuluh atom karbon. Titik didih meningkat dengan ukuran secara teratur, tetapi titik leleh tidak. Asam tak bercabang yang terdiri dari atom karbon dalam jumlah genap memiliki titik lebur lebih tinggi daripada homolog bernomor ganjil yang memiliki satu karbon lebih banyak atau lebih sedikit. Ini mencerminkan perbedaan dalam gaya tarik antarmolekul dalam keadaan kristal. Dalam tabel asam lemak kita melihat bahwa keberadaan ikatan cis-double secara signifikan menurunkan titik leleh suatu senyawa. Dengan demikian, asam palmitoleat meleleh lebih dari 60º lebih rendah dari asam palmitat, dan penurunan serupa terjadi untuk senyawa C 18 dan C 20 . Sekali lagi, perubahan dalam pengemasan kristal dan kekuatan antar molekul bertanggung jawab.
Faktor-faktor yang mempengaruhi titik didih relatif dan kelarutan air dari berbagai jenis senyawa telah dibahas sebelumnya. Secara umum, gaya tarik dipolar antara molekul bertindak untuk meningkatkan titik didih suatu senyawa, dengan ikatan hidrogen menjadi contoh ekstrem. Ikatan hidrogen juga merupakan faktor utama dalam kelarutan air dari senyawa kovalen. Untuk menyegarkan kembali pemahaman Anda tentang prinsip-prinsip ini. Tabel berikut mencantumkan beberapa contoh sifat-sifat ini untuk beberapa senyawa polar berukuran serupa (non-polar hidrokarbon heksana disediakan untuk perbandingan).
Rumus
|
Nama IUPAC
|
Berat molekul
|
Titik didih
|
Kelarutan air
|
|---|---|---|---|---|
| CH 3 (CH 2 ) 2 CO 2 H | asam butanoat | 88 | 164 ºC | sangat larut |
| CH 3 (CH 2 ) 4 OH | 1-pentanol | 88 | 138 ºC | sedikit larut |
| CH 3 (CH 2 ) 3 CHO | pentanal | 86 | 103 ºC | sedikit larut |
| CH 3 CO 2 C 2 H 5 | etil etanoat | 88 | 77 ºC | cukup larut |
| CH 3 CH 2 CO 2 CH 3 | metil propanoat | 88 | 80 ºC | sedikit larut |
| CH 3 (CH 2 ) 2 CONH 2 | butanamide | 87 | 216 ºC | larut |
| CH 3 CON (CH 3 ) 2 | N, N-dimethylethanamide | 87 | 165 ºC | sangat larut |
| CH 3 (CH 2 ) 4 NH 2 | 1-aminobutane | 87 | 103 ºC | sangat larut |
| CH 3 (CH 2 ) 3 CN | pentanenitrile | 83 | 140 ºC | sedikit larut |
| CH 3 (CH 2 ) 4 CH 3 | heksana | 86 | 69 ºC | tidak larut |
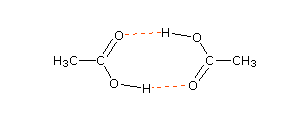
Lima entri pertama semuanya memiliki gugus fungsi oksigen, dan titik didih yang relatif tinggi dari dua entri pertama jelas disebabkan oleh ikatan hidrogen. Asam karboksilat memiliki titik didih yang sangat tinggi, sebagian besar disebabkan oleh asosiasi dimer yang melibatkan dua ikatan hidrogen. Formula struktural untuk dimer asam asetat ditunjukkan di sini. Ketika pointer mouse melewati gambar, diagram awan elektron akan muncul. Titik didih tinggi dari amida dan nitril sebagian besar disebabkan oleh daya tarik dipol yang kuat, ditambah dalam beberapa kasus dengan ikatan hidrogen.
| Formula Struktur Terkondensasi | Nama Asam | Titik lebur (° C) | Titik Didih (° C) | Kelarutan (g / 100 g air) |
|---|---|---|---|---|
| HCOOH | asam format | 8 | 100 | bercampur aduk |
| CH 3 COOH | asam asetat | 17 | 118 | bercampur aduk |
| CH 3 CH 2 COOH | propion asam ic | –22 | 141 | bercampur aduk |
| CH 3 (CH 2 ) 2 COOH | asam butirat | –5 | 163 | bercampur aduk |
| CH 3 (CH 2 ) 3 COOH | asam valerat | –35 | 187 | 5 |
| CH 3 (CH 2 ) 4 COOH | asam kaproat | –3 | 205 | 1.1 |
| C 6 H 5 COOH | asam benzoat | 122 | 249 | 0,29 |
Keasaman Asam Karboksilat
PK 's dari beberapa asam karboksilat khas tercantum dalam tabel berikut. Ketika kita membandingkan nilai-nilai ini dengan alkohol yang sebanding, seperti etanol (pK a = 16) dan 2-metil-2-propanol (pK a = 19), jelas bahwa asam karboksilat adalah asam yang lebih kuat dengan lebih dari sepuluh kekuatan sepuluh ! Selanjutnya, substituen elektronegatif dekat gugus karboksil bertindak untuk meningkatkan keasaman.
Senyawa
|
pK a
|
Senyawa
|
pK a
| |
|---|---|---|---|---|
| HCO 2 H | 3,75 | CH 3 CH 2 CH 2 CO 2 H | 4.82 | |
| CH 3 CO 2 H | 4.74 | ClCH 2 CH 2 CH 2 CO 2 H | 4.53 | |
| FCH 2 CO 2 H | 2.65 | CH 3 CHClCH 2 CO 2 H | 4.05 | |
| ClCH 2 CO 2 H | 2.85 | CH 3 CH 2 CHClCO 2 H | 2.89 | |
| BrCH 2 CO 2 H | 2.90 | C 6 H 5 CO 2 H | 4.20 | |
| ICH 2 CO 2 H | 3.10 | pO 2 NC 6 H 4 CO 2 H | 3.45 | |
| Cl 3 CCO 2 H | 0,77 | p-CH 3 OC 6 H 4 CO 2 H | 4.45 |
Mengapa kehadiran gugus karbonil yang berdekatan dengan gugus hidroksil memiliki efek mendalam pada keasaman proton hidroksil? Untuk menjawab pertanyaan ini, kita harus kembali ke sifat kesetimbangan asam-basa dan definisi pKa, yang diilustrasikan oleh persamaan umum yang diberikan di bawah ini. Hubungan-hubungan ini dijelaskan dalam bagian sebelumnya dari teks ini.
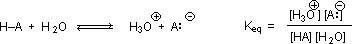
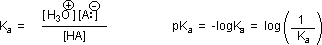
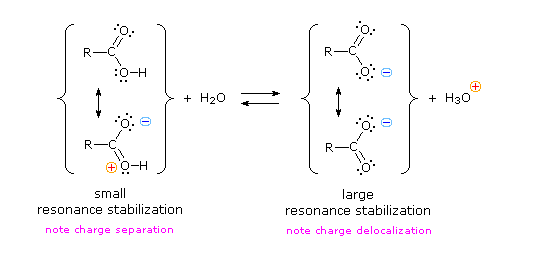
Kita tahu bahwa keseimbangan menguntungkan sisi yang lebih stabil secara termodinamik, dan besarnya konstanta kesetimbangan mencerminkan perbedaan energi antara komponen-komponen dari setiap sisi. Dalam kesetimbangan basa asam, keseimbangan selalu berpihak pada asam dan basa yang lebih lemah (ini adalah komponen yang lebih stabil). Air adalah basis standar yang digunakan untuk pengukuran pK a ; akibatnya, segala sesuatu yang menstabilkan basa konjugat (A: (-) ) dari suatu asam tentu akan membuat asam (H – A) lebih kuat dan menggeser kesetimbangan ke kanan. Baik gugus karboksil dan anion karboksilat distabilkan oleh resonansi, tetapi stabilisasi anion jauh lebih besar daripada fungsi netral, seperti ditunjukkan dalam diagram berikut. Dalam anion karboksilat dua struktur yang berkontribusi memiliki berat yang sama dalam hibrida, dan ikatan C-O memiliki panjang yang sama (antara ikatan rangkap dan ikatan tunggal).
Permasalahan :
- Pada reaksi oksidasi Cleavage dari alkena dan alkuna menggunakan reagent KMnO4 dan air serta temperature tinggi untuk menghasilkan asam karboksilat. Apa yang terjadi jika reaksi oksidasi tersebut menggunakan suhu rendah?
- Apa yang terjadi jika hidrolisis nitril direaksikan pada suasana basa? apakah asam karboksilat nya terbentuk?
- Pada reaksi oxidation of arene side-chains digunakan kalium permanganat,air dan panas. Jika yang kita gunakan adalah H3O+ sebagai pengganti H2O, produk apa yang akan terbentuk?


Komentar
Disini menggunakan temperatur yang tinggi karena KMnO4 panas ini merupakan pengoksidasi yang sangat kuat sehingga dapat memutuskan ikatan sigma dan fi agar menghasilkan asam karboksilat. Jika menggunakan suhu rendah, reaksi ini tidak stabil dalam pemutusan ikatan sigma dan fi membentuk asam karboksilat karena jika pengoksidasi kuat akan membutuhkan temperatur yang tinggi pula.
Terimakasih.
Ketika senyawa nitril dipanaskan dalam refluks dengan larutan natrium hidroksida, ternyata hasilnya juga bukan garam amonium dari asam karboksilat terkait tetapi merupakan garam natrium dan melepaskan molekul amonia.
Jika kita ingin mendapatkan asam karboksilat bebas dari reaksi ini, maka kita harus menambahkan asam ke dalam larutan produk dan asam yang digunakan adalah asam kuat seperti larutan asam hidroklorat atau asam sulfat dalam air. Ion etanoat dari garam natrium etanoat akan bereaksi dengan ion hidrogen dari asam karboksilat bebas.
saya akan menjawab no 3
Pada reaksi oxidation of arene side-chains digunakan kalium permanganat,air dan panas. apabila yang kita gunakan adalah H3O+ sebagai pengganti H2O maka produk yang di hasilkan adalah asam benzoat
Terimaksih