Mekanisme Reaksi E1
Reaksi Eliminasi Uniselular (E1)
Reaksi Umum
Reaksi E1 melibatkan deprotonasi hidrogen di dekatnya (biasanya satu karbon jauhnya, atau posisi beta) karbokation yang menghasilkan pembentukan produk alkena. Untuk mencapai ini, sebuah pangkalan Lewis diperlukan. Untuk model yang disederhanakan, kami akan menganggap B sebagai basa Lewis , dan LG menjadi grup yang meninggalkan halogen.
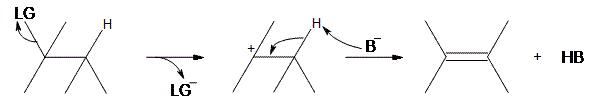
Seperti dapat dilihat di atas, langkah awal adalah meninggalkan kelompok (LG) sendiri.Karena ia membawa elektron-elektron dalam ikatan bersamanya, karbon yang melekat padanya kehilangan elektronnya, menjadikannya karbonokasi. Setelah menjadi karbokat ion, Basis Lewis (\ (B ^ - \)) mendeprotonasikan karbokation antara pada posisi beta, yang kemudian menyumbangkan elektronnya ke ikatan CC yang berdekatan, membentuk ikatan rangkap. Tidak seperti reaksi E2, yang membutuhkan proton anti terhadap kelompok yang meninggalkan, reaksi E1 hanya membutuhkan hidrogen tetangga. Ini disebabkan oleh fakta bahwa kelompok yang meninggalkan telah meninggalkan molekul.Produk akhir adalah alkena bersama dengan produk sampingan HB.
Reaktivitas
Karena fakta bahwa reaksi E1 membuat perantara karboksi , aturan yang ada dalam reaksi \ (S_N1 \) masih berlaku.
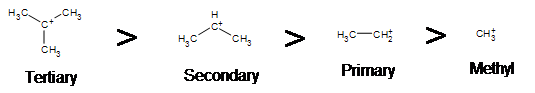
Seperti yang diharapkan, karbokation tersier lebih disukai daripada sekunder, primer dan metil. Hal ini disebabkan oleh fenomena hyperconjugation, yang pada dasarnya memungkinkan ikatan CC atau CH terdekat untuk berinteraksi dengan orbital karbon untuk membawa elektron ke keadaan energi yang lebih rendah. Jadi, ini memiliki efek stabilisasi pada molekul secara keseluruhan. Secara umum, karbonasi primer dan metil tidak diproses melalui jalur E1 karena alasan ini, kecuali ada cara pengaturan ulang karbokation untuk memindahkan muatan positif ke karbon terdekat. Karbon sekunder dan tersier membentuk karbonasi yang lebih stabil, sehingga pembentukan ini terjadi dengan sangat cepat.
Karbokation sekunder dapat dikenakan pada jalur reaksi E2, tetapi ini umumnya terjadi di hadapan basa baik / kuat. Menambahkan basa lemah ke reaksi tidak disukai E2, pada dasarnya mendorong menuju jalur E1. Dalam banyak kasus, solvolisis terjadi daripada menggunakan basa untuk mendeprotonasi. Ini berarti panas ditambahkan ke larutan, dan pelarut itu sendiri mendeprotonasi hidrogen. Media dapat mempengaruhi jalur reaksi juga. Pelarut protik polar dapat digunakan untuk menghambat nukleofil, sehingga E2 / S n 2 tidak terjadi.
Mekanisme Reaksi Eliminasi
Reaksi eliminasi terdiri dari tiga peristiwa mendasar yakni:
1. Penghapusan proton.
2.Ikatanpi C-C terbentuk.
3. Ada kerusakan dalam ikatan kelompok yang pergi.
Tergantung pada kinetika reaksi, reaksi eliminasi dapat terjadi sebagian besar oleh dua mekanisme yaitu E1 atau E2 di mana E disebut sebagai eliminasi dan angka tersebut mewakili molekul.
Permasalahan
1. Apa yang terjadi jika disosiasi kelompok yang pergi tidak membentuk karbokation?
2. Mengapa reaksi E1 hanya membutuhkan hidrogen tetangga bukan Proton anti?
3. Apa yang menyebabkan fakta yang mengatakan bahwa reaksi E1 membuat perantara karboksi?


Komentar
Aturan yang ada dalam reaksi SN1 masih berlaku pada reaksi E1 bahwa karbokation tersier lebih disukai daripada sekunder, primer dan metil. Hal ini disebabkan oleh fenomena hyperconjugation, yang pada dasarnya memungkinkan ikatan CC atau CH terdekat untuk berinteraksi dengan orbital karbon untuk membawa elektron ke keadaan energi yang lebih rendah.
Jadi, inilah yang menyebabkan bahwa reaksi E1 membuat perantara karboksi
Menurut pemikiran saya, hal tersebut tidak mungkin terjadi dikarenakan jika ada disosiasi kelompok yang pergi pada suatu alkil halida, maka pada prinsipnya gugus pergi tersebut akan kekurangan proton sehingga cenderung bersifat lebih reaktif sehingga dapat dikatakan bahwasanya gugu pergi tersebut akan membentuk karbokation.